Seguimos con el Curso para aprender formulación inorgánica desde cero hasta el infinito y mas allá profesor10demates , con cientos de ejercicios resueltos
Volver al índice del curso
Volver al índice del curso
Truco para valencias negativas profesor10demates ver explicación
Descárgate la tabla de valencias haciendo click aquí
METALES NO METALES
Elemento
|
Símbolo
|
Valencia
|
Litio
Sodio
Potasio
Rubidio
Cesio
Francio
Plata
Amonio
|
Li
Na
K
Rb
Cs
Fr
Ag
NH4 +
|
+1
|
Berilio
Magnesio
Calcio
Estroncio
Bario
Radio
Cinc
Cadmio
|
Be
Mg
Ca
Sr
Ba
Ra
Zn
Cd
|
+2
|
Aluminio
|
Al
|
+3
|
Cobre
Mercurio
|
Cu
Hg
|
+1,+2
|
Oro
|
Au
|
+1,+3
|
Niquel
Cobalto
Hierro
|
Ni
Co
Fe
|
+2+3
|
Platino
Plomo
Estaño
|
Pt
Pb
Sn
|
+2+4
|
Cromo
|
Cr
|
+2+3+6
|
Manganeso
|
Mn
|
+2+3+4+6+7
|
Elemento
|
Símbolo
|
Valencia
|
Hidrógeno
Flúor
|
H
F
|
-1 +1
|
Cloro
Bromo
Yodo
|
Cl
Br
I
|
-1 +1,+3,+5,+7
|
Azufre
Selenio
Teluro
|
S
Se
Te
|
-2 +2,+4,+6,
|
Nitrógeno
Fósforo
Arsénico
Antimonio
|
N
P
As
Sb
|
-3 +1,+3,+5
|
Carbono
Silicio
|
C
Si
|
-4 +2,+4
|
Boro
|
B
|
-3 +3
|
Oxígeno
|
O
|
-2 (-1)
|
En la naturaleza existen numerosos compuestos que deben representarse e identificarse de acuerdo a la capacidad de combinación con que actúan los elementos que intervienen en ellos.
Por tanto la nomenclatura química es el sistema de normas, comunes en todo el mundo, para denominar a los elementos y compuestos químicos.
El organismo encargado de dictar tales normas se llama Unión Internacional de Química Pura y Aplicada (IUPAC).
Clasificación de los compuestos químicos según el número de elementos que los constituyen.
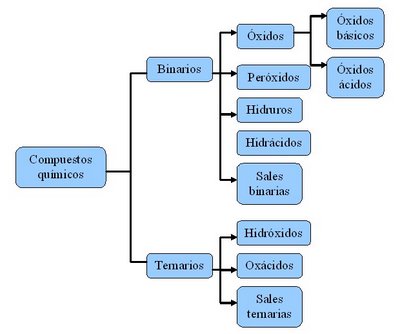
Compuestos binarios:
1. Óxidos básicos: Son combinaciones binarias de un metal con el oxígeno en las que el oxígeno utiliza el grado o estado de oxidación -2. La fórmula general que identifica a estos óxidos es la siguiente, donde M es el metal, 2 es la valencia o estado de oxidación del oxígeno, O es el oxígeno y v es la valencia del metal.
Para su nomenclatura se puede utilizar la nomenclatura IUPAC ,Stock o funcional (la más utilizada) y lanomenclatura tradicional.
Nomenclatura IUPAC: Utiliza la palabra "óxido" seguida de la partícula "de" y el "nombre del metal"; si este posee más de una valencia o grado de oxidación, se indica con cifras romanas.

Ejemplos
Na2O Óxido de sodio
FeO Óxido de ferro(II)
Fe2O3 Óxido de ferro(III)
Na2O Óxido de sodio
FeO Óxido de ferro(II)
Fe2O3 Óxido de ferro(III)
OBS: En el caso de la fórmula del óxido de hierro (II) se han simplificado las valencias Fe2O2 ------ FeO.
Nomenclatura Tradicional: Consiste en agregar a la palabra óxido el nombre del elemento terminado en"ico" (si actúa con su valencia mayor) u "oso" (si actúa con su valencia menor). Si el elemento posee una sola valencia se le hará terminar en "ico".

Ejemplos:
Na2O óxido sódico
CaO óxido cálcico
Hg2O óxido mercurioso
Fe2O3 óxido férrico
CaO óxido cálcico
Hg2O óxido mercurioso
Fe2O3 óxido férrico
Actividad:
1. Indique el nombre para los siguientes óxidos básicos. Para su resolución se recomienda utilizar la nomenclatura IUPAC. Pinche aquí
2. Escriba la fórmula que le corresponda a cada uno de los óxidos básicos que se indican. Pinche aquí
2. Óxidos ácidos:Son combinaciones binarias de un no metal y el oxígeno, en las que análogamente a los anteriores el oxígeno utiliza el grado de oxidación -2. Su fórmula general es la siguiente, donde NM es el no metal, 2 es la valencia o estado de óxidación del oxígeno, O es el oxígeno y v es el estado de oxidación del no metal.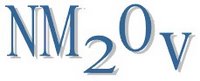
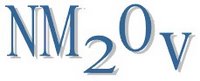
Para nombrarlos, se utiliza la nomenclatura de proporciones o sietmática (clásicamente se les denominabaanhídridos).
 Para nombrarlos también se utiliza la nomenclatura de Stock y tradicional, teniendo presente que cuando se les nombra en la nomenclatura tradicional la palabra óxido se cambia por anhídrido.
Para nombrarlos también se utiliza la nomenclatura de Stock y tradicional, teniendo presente que cuando se les nombra en la nomenclatura tradicional la palabra óxido se cambia por anhídrido.

 Para nombrarlos también se utiliza la nomenclatura de Stock y tradicional, teniendo presente que cuando se les nombra en la nomenclatura tradicional la palabra óxido se cambia por anhídrido.
Para nombrarlos también se utiliza la nomenclatura de Stock y tradicional, teniendo presente que cuando se les nombra en la nomenclatura tradicional la palabra óxido se cambia por anhídrido.
Ejemplo: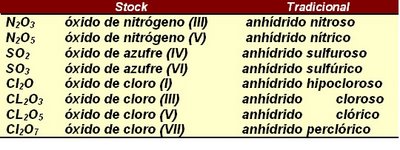 Nota:
Nota:
 Nota:
Nota:- Cuando nombremos algunos compuestos en la nomenclatura tradicional, debemos tener en cuenta que algunos elementos cambian su nombre por su raíz correspondiente.

- Como en la nomenclatura tradicional se utilizan las terminaciones oso e ico, para identificar la valencia o estado de oxidación con la cual participa el elemento en el compuesto, debemos realizar una diferenciación de estas terminaciones para aquellos elementos que poseen más de 2 valencias o estados de óxidación. Por esta razón, se resumen a continuación estas diferencias.

Casos especiales
- En el caso del cromo y el manganeso, como ambos son elementos anfóteros, es decir pueden actuar como metal y no metal, con su valencia 2 y 3 respectivamente forman óxidos básicos y con sus valencias 4, 6 y 7 respectivamente forman óxidos ácidos. Por lo cual con los primeros se originan hidróxidos y con los segundos oxiácidos.

Actividad
1. Coloque el nombre a los siguientes compuestos. Para ello se recomienda utilizar la nomenclatura sistemática. Pinche aquí
2. Escriba la fórmula correspondiente. Pinche aquí
3. Hidruros: Son combinaciones binarias de cualquier elemento con el hidrógeno, en las que dicho elemento utiliza la valencia 1.
- Para hidruros metálicos, se utiliza la palabra hidruro seguida de la partícula de y el nombre delmetal (notación de Stock). También pueden ser nombrados por la nomenclatura tradicional. La fórmula general de los hidruros metálicos es:


- Para hidruros no metálicos, que son combinacións del hidrógeno con elementos del grupo VA, con el C y Si del grupo del carbono (grupo VIA), y con el B del grupo IIIA. Se nombran con la nomenclatura tradicional aunque también es correcto emplear la nomenclatura estequiométrica o sistemática.
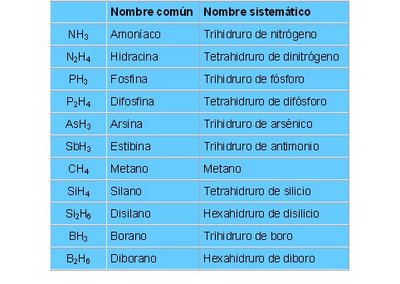
Actividad:
1. Escribe el nombre de los siguientes hidruros metálicos. Pincha aquí
2. Escribe la fórmula que corresponda para los hidruros metálicos. Pincha aquí
1. Escribe el nombre de los siguientes hidruros metálicos. Pincha aquí
2. Escribe la fórmula que corresponda para los hidruros metálicos. Pincha aquí
3. Escribe el nombre de los siguientes hidruros no metálicos. Pincha aquí
4. Escriba las fórmulas que corresponda para los hidruros no metálicos. Pincha aquí
4. Hidrácidos: Cuando se trata de los elementos más no metálicos (del grupo VI y VIIA, los cuales actúan con su valencia o estado de oxidación menor) y dado su carácter ácido (ácidos hidrácidos) se les puede nombrar utilizando el prefijo ácido seguido de la partícula de y el nombre del no metal acabado en hídrico. La fórmula general de estos compuestos es:
4. Hidrácidos: Cuando se trata de los elementos más no metálicos (del grupo VI y VIIA, los cuales actúan con su valencia o estado de oxidación menor) y dado su carácter ácido (ácidos hidrácidos) se les puede nombrar utilizando el prefijo ácido seguido de la partícula de y el nombre del no metal acabado en hídrico. La fórmula general de estos compuestos es:

 Actividad:
Actividad:
1. Escribe el nombre de los siguientes hidrácidos. Pincha aquí
2. Escribe las fórmulas que corresponda. Pincha aquí
5. Sales binarias: Son combinaciones binarias de un metal y un no metal. Para su nomenclatura se utiliza el nombre del no metal terminado en uro seguido del genitivo de y el nombre del metal; si el metal posee más de una valencia se indica detrás del nombre del metal, en cifras romanas (notación Stock). En la fórmula la parte electropositiva o metálica se coloca delante. Estas sales también pueden nombrarse mediante la nomenclatura tradicional. La fórmula general es:



Actividad:
1. Escribe el nombre de las siguientes sales binarias. Pincha aquí
2. Escribe la fórmula que corresponda. Pincha aquí
6. Combinaciones binarias entre no metales: Se nombran utilizando el nombre del elemento más electronegativo de los dos que forman el compuesto con la terminación uro seguida de la partícula de y elnombre del otro elemento no metálico. El elemento menos electronegativo se coloca primero en la fórmula. Es recomendable la nomenclatura de proporciones o sistemática.
6. Combinaciones binarias entre no metales: Se nombran utilizando el nombre del elemento más electronegativo de los dos que forman el compuesto con la terminación uro seguida de la partícula de y elnombre del otro elemento no metálico. El elemento menos electronegativo se coloca primero en la fórmula. Es recomendable la nomenclatura de proporciones o sistemática.

En dichas combinaciones se coloca delante el elemento que es primero en la siguiente lista: B, Si, C, Sb, As, P, N, H, S, I, Br, Cl, O, F. Esta relación corresponde a un orden creciente del electronegatividades.








No hay comentarios:
Publicar un comentario